Se estima que alrededor de un tercio de la población mundial están infectadas con Mycobacterium tuberculosis, bacilo causante de la tuberculosis; aproximadamente 8 millones de ellos enferman anualmente y cerca de dos millones mueren por la enfermedad, aún cuando se cuenta con técnicas de diagnóstico sencillas, precisas y con tratamientos eficaces.
Se estima que alrededor de un tercio de la población mundial están infectadas con Mycobacterium tuberculosis, bacilo causante de la tuberculosis; aproximadamente 8 millones de ellos enferman anualmente y cerca de dos millones mueren por la enfermedad, aún cuando se cuenta con técnicas de diagnóstico sencillas, precisas y con tratamientos eficaces.La transmisión de los bacilos de la tuberculosis se produce casi exclusivamente por medio de núcleos suspendidos en pequeñas gotas que son expulsadas con la expectoración de las personas afectadas por tuberculosis pulmonar. Estas pequeñas gotas pueden permanecer infectantes en el aire durante bastante tiempo y pueden ser inhaladas por otras personas. La infección de los contactos es más probable cuando conviven o permanecen durante un tiempo prolongado cerca del enfermo que está expectorando bacilos y en un ambiente poco ventilado. No todas las personas infectadas se enferman, sólo una de cada diez personas aproximadamente, son las más susceptibles. La tuberculosis puede manifestarse en cualquier órgano, porque Mycobacterium tuberculosis se disemina por todo el organismo; sin embargo, la enfermedad pulmonar es la más frecuente, debido a que el bacilo necesita abundante oxígeno para multiplicarse. En los pulmones de los enfermos se pueden formar cavidades en las que se alojan grandes poblaciones de bacilos que pueden ser detectados en muestras de esputos.
El diagnóstico de certeza de tuberculosis puede hacerse en forma confiable en el laboratorio, demostrando la presencia de bacilos en una muestra de la lesión por medio de la baciloscopia (examen microscópico) o el cultivo. Para que la baciloscopia sea positiva es preciso que la muestra tenga como mínimo, entre 5.000 y 10.000 bacilos por mililitro de muestra. Este alto contenido de bacilos se encuentra en los pacientes con tuberculosis pulmonar, especialmente en aquellos con enfermedad avanzada y con lesiones cavitadas. Estos pacientes son los que transmiten los bacilos manteniendo la enfermedad en la comunidad.
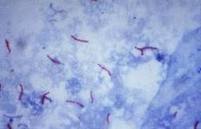
La baciloscopia es la técnica de elección para el diagnóstico rápido y control del tratamiento de la tuberculosis pulmonar del adulto. Es simple, económica y eficiente para detectar los casos infecciosos, por eso es la herramienta fundamental de un programa de control de la tuberculosis. Agregando a esto, esta la coloración de Ziehl Neelsen, la cual es una técnica de tinción diferencial rápida para la identificación de microorganismos patógenos como es el caso de la Mycobacterium tuberculosis.
La coloración de Ziehl Neelsen es la técnica más apropiada para ser utilizada en todos los laboratorios de los países de América Latina. Es la recomendada por la Organización Mundial de la Salud (OMS) y la Unión Internacional Contra la Tuberculosis y Enfermedades Respiratorias (UICTER) por ser la que asegura resultados reproducibles con un entrenamiento sencillo y la más económica. Esta tinción está basada en el calentamiento del colorante para que este atraviese la pared bacteriana que contiene ceras. Al suspender el calentamiento y enfriar con agua, provoca una nueva solidificación de los ácidos grasos de modo que el colorante ya no pueda salir de la bacteria. Por otro lado el calentamiento aumenta la energía cinética de las moléculas del colorante lo cual también facilita su entrada a las bacterias.
Las bacterias que resisten la decoloración son de color rojo y las que no, se observan de color azul, ya que se utiliza azul de metileno como tinción de contraste.